Изучение полиморфизма генов при ожирении у жителей россии
Изучение полиморфизма генов при ожирении у жителей России
Резюме. В консультативно-диагностическом центре «Здоровое питание» ФГБНУ «НИИ питания» проведено обследование пищевого статуса 3580 пациентов (средний возраст — 48,4±0,3 года), включающее современные подходы к геномному и постгеномному анализу.
30,0% пациентов имели избыточную массу тела, а 34,1% страдали ожирением. Установлена частота встречаемости аллелей риска генов, связанных с развитием ожирения: 45,1% — для полиморфизма rs9939609 гена FTO, 7,8% — для полиморфизма rs4994 гена ADRB3, 60,2% — для полиморфизма rs659366 гена UCP2 и 36,6% — для полиморфизма rs5219 гена АТФ-зависимого калиевого канала.
Полученные результаты позволяют разработать персональную диету на основе диагностики пищевого статуса пациента, включающей современные подходы к геномному и постгеномному анализу.
Ключевые слова: фактическое питание, пищевой статус, гипергликемия, плотность костной ткани, полиморфизм генов.
The study of the association of polymorphism obesity among residents of Russia
A.K. Baturin, A.V. Pogozheva, E.Y. Sorokina, E.V. Peskovа, O.N Makurina., V.A. Tutelian
Institute of Nutrition, Moscow, Russia
Resume. In a consultative and diagnostic center «Healthy Nutrition» of Institute of Nutrition the nutritional us of 3580 patients (mean age 48,4±0,3 years), including genomic analysis has been examined.
30,0% of patients were overweight and 34,1% were obese. The frequency of the occurrence of risk alleles of genes associated with the development of obesity was: 47,8% — for the polymorphism rs9939609 (FTO gene), 7,8% — for polymorphism rs4994 (gene ADRB3), 60,2% — for the polymorphism rs659366 (gene UCP2), 36,6% — for the rs5219 polymorphism in the gene of ATP-dependent potassium channel.
These results can be used for the development of a personalized diet based on diagnostic patient nutritional us, including genomic analysis has been examined.
Keywords: dietary intake, nutritional us, hyperglycemia, bone density, gene polymorphism.
В настоящее время ожирение представляет собой актуальную проблему, что связано с его прогрессирующим распространением и тяжестью осложнений, которые нередко становятся причиной смерти больных в молодом возрасте. По данным Международной целевой группы по борьбе с ожирением, около 1 млрд взрослых имеют избыточную массу тела, а 475 млн из них страдают этой патологией. С конца ХХ в. во всем мире число лиц с ожирением более чем удвоилось [1, 2].
Это может быть обусловлено как внешними факторами (неправильным образом жизни, в т. ч. разбалансированным питанием), так и генетическими нарушениями. Считают, что средовые факторы риска, связанные с изменением характера питания и физической активности, могут реализоваться только на фоне генетических факторов [3, 4]. В связи с этим большой интерес представляет идентификация генов-кандидатов ожирения. При обследовании детей и взрослых в различных популяциях выявлено более 100 генетических полиморфизмов, связанных с этим заболеванием [5-7].
Так, показана выраженная ассоциация полиморфизма rs9939609 гена FTO с увеличением индекса массы тела (ИМТ), жировой массы, отсутствием чувства насыщения пищей и повышением (в 1,5-2 раза) риска развития ожирения [8, 9]. Наиболее тесная связь установлена между ожирением и полиморфизмом этого гена в европейской, японской и мексиканской популяциях. Частота встречаемости мутантного аллеля FTO составляет 46-51% среди жителей Западной и Центральной Европы, Западной Африки и только 16% — в Китае [10, 11].
Важную роль в регуляции величины жировой массы играет и полиморфизм гена b3-адренорецепторов (ADRB3), который также может рассматриваться в качестве гена-кандидата ожирения. Мутация в кодоне 64 из ADRB3 приводит к замене триптофана на аргинин (Trp64Arg) в белке рецептора и ассоциируется с повышенной массой тела. Результаты исследований с включением 11 тыс. человек свидетельствуют о том, что мутация Trp64Arg гена ADRB3 широко распространена в нескольких этнических группах и связана с увеличением массы тела, висцеральным ожирением, резистентностью к инсулину и более ранним (на 22 года раньше) развитием сахарного диабета (СД) 2-го типа [12, 13].
Значительное количество исследований посвящено генам, связанным с энерготратами, таким как гены, кодирующие митохондриальные разобщающие белки (UCPs), которые представляют собой семейство мембранных белков, носителей анионов, расположенных на внутренней мембране митохондрий [14]. Наиболее изученным в этом плане является полиморфизм rs659366 гена разобщающего белка 2 (UCP2) — ключевого регулятора энергетического баланса. Он присутствует на внутренней мембране митохондрий, опосредует утечку протонов через внутреннюю мембрану путем разобщения окисления АТФ, таким образом уменьшая производство АТФ в митохондриальной дыхательной цепи. Эффектом UCP2 может быть ингибирование стимулированной глюкозой секреции инсулина [15].
Метаанализ, включающий 12 исследований полиморфизма rs659366 гена UCP2, с общим количеством обследованных 7390 (контрольная группа) и 9890 (пациенты с ожирением), показал статистически значимую ассоциацию с ожирением у выходцев из Европы, в отличие от выходцев из Азии, где связи с ожирением не выявлено [16].
Патогенез ожирения связан с нарушениями обменных процессов, которые могут приводить к инсулинорезистентности, нарушенной толерантности к глюкозе и развитию СД 2-го типа, который включает комплекс метаболических нарушений, характеризующихся изменением секреции инсулина и инсулинорезистентностью. Известно, что секрецию инсулина β-клетками поджелудочной железы регулирует АТФ-зависимый калиевый канал посредством влияния на метаболизм глюкозы на уровне мембран клеток. Наиболее изученным в целом ряде этнических групп в настоящее время является полиморфный маркер этого гена rs5219, в котором происходит замена цитозина на тимин в позиции 67, приводящая к замене глутаминовой кислоты в позиции 23 аминокислотной последовательности белка на лизин [17-20].
Показана ассоциация этого полиморфизма с риском развития СД 2-го типа у европейцев, в индоевропейской этнической группе, у американцев европейского происхождения, японцев и китайцев [21-25]. Установлена связь полиморфизма rs5219 гена KCNJ11 с риском развития СД 2-го типа у жителей арабских государств, а у жителей Японии и Южной Кореи — также связь и с риском развития артериальной гипертензии [26-28]. В турецкой популяции выявлена статистически значимая связь аллеля Т со снижением уровня секреции инсулина [29].
Ранее нами была изучена связь полиморфизмов rs9939609 гена FTO и Trp64Arg гена ADRB3 с риском ожирения у жителей различных регионов России [30-33].
Целью настоящего исследования явилось изучение ассоциации полиморфизма 4 генов c ожирением у жителей Российской Федерации.
Материалы и методы
В консультативно-диагностическом центре «Здоровое питание» ФГБНУ «НИИ питания» проведено обследование пищевого статуса 3580 пациентов (средний возраст — 48,4±0,3 года), проживающих в РФ, из них 34,1% пациентов имели ИМТ >30 кг/м2.
Биохимические показатели, характеризующие состояние липидного, белкового и углеводного обмена, определяли c использованием анализатора «ABX PENTRA 400» (HORIBA ABX SAS, Франция) в автоматическом режиме.
Определение состава тела (содержания воды, абсолютной и относительной массы мышечной и жировой ткани) проводили при помощи программного обеспечения «Looking`Body» анализатора «InBody 720» (Biospac, Корея).
Исследование энерготрат в состоянии покоя выполняли методом непрямой калориметрии с использованием портативного метаболографа «VO2000» (MedGraphics, CША).
Для исследования полиморфизма генов ДНК выделяли из крови стандартным методом с использованием многокомпонентного лизирующего раствора, разрушающего комплекс ДНК с белком и с последующей сорбцией на магнитные частицы, покрытые силикагелем, и набора реагентов «РеалБест ДНК-экстракция 3» (ЗАО «Вектор-Бест», Новосибирск, РФ). Выделение ДНК осуществляли на автоматической станции «epMotion 5075» (Eppendorf, Германия).
Генотипирование проводили с применением аллель-специфичной амплификации с детекцией результатов в режиме реального времени и использованием TaqMan-зондов, комплементарных полиморфным участкам ДНК [23]. Для проведения амплификации использовали амплификатор «CFX96 Real System» (BIO-RAD, США).
Статистическую обработку полученных результатов проводили с использованием системы PASW istics 20. Тесты на соблюдение равновесия Харди — Вайнберга и выявление ассоциаций методом Пирсона χ2 выполняли с помощью программы DeFinetti на сайте Института генетики человека (Мюнхен, Германия).
Результаты исследования
Анализ результатов исследований полиморфизмов генов: rs9939609 гена жировой ткани FTO, rs4994 гена β3-адренорецептора (ADRB3), rs659366 гена разобщающего белка 2 (UCP2), rs5219 гена АТФ-зависимого калиевого канала (KCNJ11) свидетельствовал о наличии связи этих полиморфизмов с риском развития ожирения у населения России.
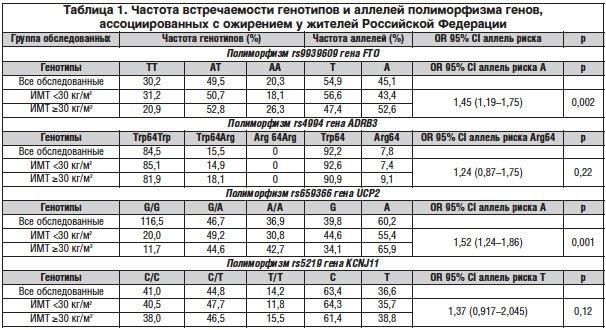
Как видно из таблицы 1, у жителей некоторых регионов РФ (Московского и Свердловского) отмечалась достаточно частая встречаемость мутантного аллеля rs9939609 гена FTO (47,8%). При этом у женщин наличие мутантного аллеля отмечалось несколько чаще, чем у мужчин (48,4 против 42,5%). Генотип ТТ был выявлен в 30,2% случаев, АТ — в 49,5%, АА — в 20,3%.
У лиц с ожирением по сравнению с испытуемыми с нормальной массой тела была выявлена достоверно более высокая частота встречаемости (соответственно 52,9 и 45%) аллеля риска А (OR — 1,67, CI 1,20-2,31, p=0,02). Полученные данные свидетельствуют о достоверно более высоком ИМТ у лиц с АТ- (р<0,01) и особенно АА- (р<0,001) генотипом по сравнению с ТТ-типом гена FTO, что сочеталось у них с большей величиной жировой массы и уровнем триглицеридов в сыворотке крови.
Среди населения Московского и Свердловского регионов наличие мутантного аллеля гена ADRB3 отмечалось в 7,8% случаев. При этом 15,5% обследованных имели гетерозиготный Trp64Arg генотип ADRB3, что согласуется с данными зарубежных исследований. Частота встречаемости аллеля риска Arg64 и генотипа Trp64Arg у женщин (соответственно 9,3 и 18,5%) по сравнению с таковой у мужчин (6,2 и 12,2%) была достоверно выше.
У обследованных с ожирением значительно чаще отмечалось наличие мутантного аллеля и Trp64Arg генотипа ADRB3 (соответственно 9,1 и 18,1%) по сравнению с лицами с ИМТ <30 кг/м2 (7,4 и 14,9%), однако эти различия были статистически не достоверны. При этом у носителей мутантного аллеля в гетерозиготном состоянии чаще встречались ожирение более высоких степеней, метаболический синдром и СД 2-го типа, наблюдалось увеличение средних показателей ИМТ, жировой массы (р<0,05), повышение уровня глюкозы и мочевой кислоты в сыворотке крови.
При сочетании генотипа Trp64Arg с АТ- и АА-генотипами FTO у обследованных отмечались достоверно более высокие ИМТ, соответственно на 11% (р<0,05) и 12% (р<0,001), по сравнению с теми лицами, у которых отсутствовала мутация обоих генов (Trp64/ТТ).
Результаты исследования полиморфизма rs659366 гена UCP2 показали, что 36,9% пациентов имели генотип АА, 46,7% — генотип AG и только 16,5% — генотип GG. Частота встречаемости аллеля А составляла 60,2%, аллеля G — 39,8%. При этом у носителей аллеля А в гомозиготном и гетерозиготном состоянии ИМТ величина жировой массы, площадь висцерального жира, а также содержание в сыворотке крови глюкозы и триглицеридов были достоверно выше, чем у носителей аллеля G в гомозиготном состоянии. Частота обнаружения мутантного аллеля А по сравнению с «диким» аллелем G у обследованных с ожирением (ИМТ >30 кг/м2) составила: OR — 1,52, CI 1,24-1,86, p=0,001.
Частота встречаемости мутантного аллеля Т rs5219 гена KCNJ11 составляла 36,6%. У мужчин, имеющих генотип ТТ, при гомо- и гетерозиготном типах величина энерготрат в покое, рассчитанная на 1 кг мышечной массы тела, была достоверно ниже. У обследованных с ожирением (ИМТ ≥30 кг/м2) частота встречаемости мутантного аллеля Т была несколько выше, но статистически значимо не отличалась от частоты у обследованных с ИМТ <30 кг/м2 (соответственно 38,8 и 35,7%), OR — 1,14, CI 0,907-1,439, p=0,26. В то же время величина энерготрат в покое, рассчитанная на 1 кг мышечной массы тела, была достоверно ниже у мужчин, имеющих полиморфизм rs5219 гена KCNJ11, как при гомо-, так и при гетерозиготном типе.
В то же время у пациентов с гипергликемией частота встречаемости аллеля Т rs5219 гена KCNJ11 была выше, чем в группе сравнения, на 7,6%, а генотипа ТТ — на 13,0%. Выявлена ассоциация генотипа ТТ с риском развития СД 2-го типа (OR=2,35, CI 1,018-5,43, p=0,04).
Результаты исследований свидетельствуют о том, что полиморфизм изученных генетических вариантов: rs9939609 гена жировой ткани FTO, rs4994 гена β3-адренорецептора (ADRB3), rs659366 гена разобщающего белка 2 (UCP2), rs5219 гена KCNJ11 вносит свой вклад в развитие ожирения и метаболических нарушений у жителей РФ. При этом риск развития ожирения увеличивается в случае наличия сочетанного полиморфизма этих генов.
Частота встречаемости аллелей риска ожирения у пациентов составила 7,8-60,2%, что сочеталось с разбалансированностью их рациона питания и нарушением пищевого статуса (увеличение ИМТ, жировой массы и площади висцерального жира, содержания глюкозы, триглицеридов, мочевой кислоты в сыворотке крови).
Проведенные исследования позволяют осуществить персональную алиментарную коррекцию нарушений пищевого статуса.
Литература
1. International Obesity Taskforce: Obesity the global epidemic [https://www.iaso.org/iotf/ obesity/obesitytheglobalepidemic].
2. Shaw J.E., Sicree R.A., Zimmet P.Z. Global estimates of the prevalence of diabetes for 2010 and 2030 // Res Clin Pract. 2010. Vol. 87. Р. 4-14.
3. McCarthy M.I. Genomics, type 2 diabetes, and obesity // N Engl J Med. 2010. Vol. 363. Р. 2339-2350.
4. Wang C.P., Chung F.M., Shin S.J., Lee Y.J. Congenital and environmental factors associated with adipocyte dysregulation as defects of insulin resistance // Rev Diabet Stud. 2007. Vol. 4. Р. 77-84.
5. Carlos F., Silva-Nunes С.J et al. Association of FTO and PPARG polymorphisms with obesity in Portuguese women // Diabetes, bolic Syndrome and Obesity // Targets and Therapy. 2013. Vol. 6. Р. 241-245.
6. Marcadenti А., Fuchs F.D. Effects of FTO rs9939609 and MC4R rs17782313 on obesity, type 2 diabetes mellitus and blood pressure in patients with hypertension // Cardiovascular Diabetology. 2013. Vol. 12. Р. 103.
7. Silva С.F., Zandoná M.R. et al. Association between a frequent variant of the FTO gene and anthropometric phenotypes in Brazilian children // BMC Medical Genetics. 2013. Vol. 14. Р. 34.
8. Mitchell J., Church T., Rankinen T. et al. FTO Genotype and the Weight Loss Benefits of Moderate Intensity Exercise // Obesity. 2010. Vol. 18. Р. 641-643.
9. Zimmermann E., Skogstrand K., Hougaar D.M. et al. Influences of the Common FTO rs9939609 Variant on Inflammatory Markers Throughout a Broad Range of Body Mass Index // PLoS One. 2011. Vol. 5. Р. 5958.
10. Hennig B., Fulford A., Sirugo G. et al. Prentice A. M. FTO gene variation and measures of body mass in an African population // BMC Medical Genetics. 2009. Vol. 10. Р. 21.
11. Legry V., Cottela D, Ferrieresb J. et al. Effect of an FTO polymorphism on fat mass, obesity, and type 2 diabetes mellitus in the French MONICA Study // bolism Clinical and Experimental. 2009. Р. 971-975.
12. De Luis D., Sagrado М., Aller R. et al. Influence of the Trp64Arg polymorphism in the beta 3 adrenoreceptor gene on insulin resistance, adipocytokine response, and weight loss secondary to lifestyle modification in obese patients // European J. of Internal Medicine. 2007. Vol. 18. Р. 587-592.
13.Thomas G., Tomlinson B., Chang J. et al. The Trp64Arg polymorphism of the beta 3 adrenergic receptor gene and obesity in Chinese subjects with components of the bolic syndrome // Int. J.Obes. Relat. b. Disord. 2000. Vol. 25. Р. 545-551.
14. Dalgaard L.T. Genetic Variance in Uncoupling Protein 2 in Relation to Obesity, Type 2 Diabetes, and bolic Traits: Focus on the al −866G>A ter Variant (rs659366) // Journal of Obesity. 2011. № 2. P. 1-12.
15. Chan C.B., Kashemsant N. Regulation of insulin secretion by uncoupling protein // Biochem Soc Trans. 2006. Vol. 34. Р. 802-805.
16. Li Qian, Kuanfeng X., Xinyu X. et al. UCP2 -866G/A, Ala55Val and UCP3 -55C/T Polymorphisms in Association with Obesity Susceptibility — A -Analysis Study // PLoS One. 2013. Vol. 8, № 4. Р. 58939.
17. Mao H., Li. Q, Gao S. -Analysis of the Relationship between Common Type 2 Diabetes Risk Gene Variants with Geional Diabetes Mellitus // PLoS One. 2012. Vol. 7. Issue 9. Р. 45882.
18. Omar A. Genetics of type 2 diabetes // World J Diabetes. 2013. Vol. 4. P. 114-123.
19. Qiu L., Na R., Xu R. et al. Quantitative Assessment of the Effect of KCNJ11 Gene Polymorphism on the Risk of Type 2 Diabetes // PLoS One. 2014. Vol. 9. Р. 93961.
20. Qin L., Lv Y., Huang Q. -analysis of association of common variants in the KCNJ11-ABCC8 region with type 2 diabetes // Genetics and Molecular Re. 2013. Vol. 12. № 3. P. 2990-3002.
21. Cejkova´ P., Novota P., Cerna´ M. et al. KCNJ11 E23K polymorphism and diabetes mellitus with adult onset in Czech patients // Folia Biol (Praha). 2007. Vol. 53. P. 173-175.
22. Chauhan G., Spurgeon C., Tabassum R. et al. Impact of common variants of PPARG, KCNJ11, TCF7L2, SLC30A8, HHEX, CDKN2A, IGF2BP2 and CDKAL1 on the risk of type 2 diabetes in 5164 Indians // Diabetes. 2010. Vol. 59. P. 2068-2074.
23. Lyssenko V., Jonsson A., Almgren P. et al. Clinical risk factors, DNA variants, and the development of type 2 diabetes // N Engl J Med. 2008. Vol. 359. P. 2220-2232.
24. Takeuchi F., Serizawa M., Yamamoto K. et al. Confirmation of multiple risk Loci and genetic impacts by a genome-wide association study of type 2 diabetes in the Japanese population // Diabetes. 2009. Vol. 58. P. 1690-1699.
25. Hu C., Zhang R., Wang C. et al. PPARG, KCNJ11, CDKAL1, CDKN2A-CDKN2B, IDE-KIF11-HHEX, IGF2BP2 and SLC30A8 are associated with type 2 diabetes in a Chinese population // PLoS One 4. 2009. Р. 7643.
26. Ezzidi I., Mtiraoui N., Cauchi S. et al. Contribution of type 2 diabetes associated loci in the Arabic population from Tunisia: a case-control study // BMC Med Genet. 2009. Vol. 15. P. 10-33.
27. Koo B., Cho Y., Park B. et al. Polymorphisms of KCNJ11 (Kir6.2 gene) are associated with Type 2 diabetes and hypertension in the Korean population // Diabet Med. 2007. Vol. 24. P. 178-186.
28. Sakamoto Y., Inoue H., Keshavarz P. et al. SNPs in the KCNJ11-ABCC8 gene locus are associated with type 2 diabetes and blood pressure levels in the Japanese population // J Hum Genet. 2007. Vol. 52. P. 781-793.
29. Gonen M., Arikoglu H., Erkoc K. et al. Effects of nucleotide polymorphisms in K(ATP) channel genes on type 2 diabetes in a Turkish population // Arch Med Res. 2012. Vol. 43. P. 317-323.
30. Батурин А.К., Погожева А.В., Сорокина Е.Ю., Макурина О.Н., Тутельян В.А. Изучение полиморфизма rs9939609 гена FTO у лиц с избыточной массой тела и ожирением // Вопросы питания. 2011. № 3. С. 13-17.
31. Батурин А.К., Погожева А.В., Сорокина Е.Ю., Макурина О.Н., Тутельян В.А. Изучение Trp64Arg полиморфизма гена ß3-адренорецепторов у лиц с избыточной массой тела и ожирением // Вопросы питания. 2012. № 2. С. 23-27.
32. Батурин А.К., Сорокина Е.Ю., Погожева А.В., Тутельян В.А. Генетические подходы к персонализации питания // Вопросы питания. 2012. № 6. С. 4-11.
33. Батурин А.К., Сорокина Е.Ю., Погожева А.В., Пескова Е.В., Макурина О.Н., Тутельян В.А. Изучение региональных особенностей полиморфизма rs9939609 гена FTO и Trp64Arg гена ADRB3 у населения Российской Федерации // Вопросы питания. 2014. № 2. С. 35-41.
Источник
Изучение связи генетических полиморфизмов с потреблением некоторых пищевых веществ
Характер питания — один из важнейших поведенческих факторов, играющих огромную роль в возникновении и прогрессировании ряда неинфекционных алиментарно-зависимых заболеваний [1, 2]. Благодаря активному внедрению молекулярно-генетических технологий в практику здравоохранения стало известно, что значительную роль в пищевом поведении человека играет генетический фактор [3, 4]. В последние десятилетия доказан существенный вклад целого ряда генетических полиморфизмов в развитие алиментарно-зависимых заболеваний, связанных с нарушением пищевого поведения [4-7].
Вопрос влияния генетических полиморфизмов на пищевое поведение жителей Российской Арктики изучен недостаточно. В ряде работ [8, 9] показано, что частота генетических полиморфизмов, ассоциированных с риском развития алиментарно-зависимых заболеваний, у населения Крайнего Севера отличается от частоты в европейских и азиатских популяциях, однако фенотипическое проявление этих полиморфизмов остается практически не изученным.
Цель исследования — изучение связи генетических полиморфизмов rs9939609 гена FTO, rs4994 гена ADRB3, rs659366 гена UCP2 и rs5219 гена KCNJ11 у населения Арктической зоны РФ (Ямало-Ненецкий автономный округ) c содержанием в рационах жира, насыщенных жирных кислот (НЖК), углеводов и добавленного сахара, избыточный уровень потребления которых является фактором риска развития таких алиментарно-зависимых заболеваний, как сердечно-сосудистые, артериальная гипертензия, ожирение, сахарный диабет и др. [1, 10]. Согласно «Нормам физиологических потребностей в энергии и пищевых веществах» и рекомендациям ВОЗ потребление жира, НЖК должно составлять соответственно не более 30 и 10% от суточной калорийности рациона, углеводов в целом — 56-58%, в том числе добавленного сахара не более 10% от суточной калорийности рациона [10, 11].
Полиморфизмы rs9939609 гена FTO, rs4994 гена ADRB3, rs659366 гена UCP2, как было показано в европейских популяциях, ассоциированы с риском ожирения. Результаты исследований у детей в возрасте 4-5 лет с носительством аллеля, А полиморфизма rs9939609 выявили потерю контроля за потреблением пищи и предпочтение более высококалорийной пищи по сравнению с носителями генотипа ТТ [12]. Результаты метаанализа с участием 11 000 обследованных свидетельствуют, что у лиц с генотипом СТ гена ADRB3 индекс массы тела в среднем на 0,3 кг/м2 выше, чем у носителей генотипа ТТ, а также наблюдается более раннее (на 22 года) развитие сахарного диабета 2-го типа [13]. Авторы метаанализа [14, 15], включившего 12 исследований полиморфизма rs659366 гена UCP2 с общим количеством обследованных 7390 (контрольная группа) и 9890 (пациенты с ожирением) показали статистически значимую ассоциацию с ожирением у выходцев из Европы, в отличие от выходцев из Азии, где связь с ожирением не выявлена. Полиморфизм rs5219 гена KCNJ11, как было установлено при обследовании европейцев и американцев европейского происхождения, ассоциирован с сахарным диабетом 2-го типа [16, 17].
Исследование фактического питания и генетических полиморфизмов коренного и пришлого населения было проведено в поселках Тазовский и Гыда Тазовского района муниципального образования на северо-востоке Ямало-Ненецкого автономного округа. Обследованы 175 человек (135 женщин и 40 мужчин) в возрасте от 19 до 75 лет, проживающих на территории Арктической зоны Р.Ф. Среди всех обследованных 81% составляло коренное население Арктической зоны, на 98% представленное ненцами. Для анализа фактического питания использовался 24-часовой (суточный) метод воспроизведения.
ДНК выделяли из буккального эпителия стандартным методом с использованием многокомпонентного лизирующего раствора, разрушающего комплекс ДНК с белком, затем ДНК сорбировали на покрытые силикагелем магнитные частицы, отмывали спиртом и на конечном этапе элюировали в буферный раствор. Для выделения ДНК использовали набор реагентов РеалБест ДНК-экстракция 3 (ЗАО «Вектор-Бест», Россия). Выделение проводилось на автоматической станции epMotion 5075 («Eppendorf», Германия). Генотипирование проводили с применением аллель-специфичной амплификации с детекцией результатов в режиме реального времени и использованием TaqMan-зондов, комплементарных полиморфным участкам ДНК [5, 18]. Для проведения амплификации использовали амплификатор CFX96 Real System (BIO-RAD, США).
Статистическую обработку полученных результатов проводили с использованием системы PASW istics 20. Тесты на соблюдение равновесия Харди-Вайнберга и выявление ассоциаций методом Пирсона χ2 проводили с помощью программы DeFinetti на сайте Института генетики человека (Мюнхен, Германия)1.
Для выявления связи изучаемых генетических полиморфизмов с уровнем потребления жиров проведено исследование по типу «случай-контроль». Все обследуемые были распределены в две группы: участники 1-й группы потребляли жира в количестве более 30% от суточной калорийности рациона (случай), представители 2-й группы — менее 30% от суточной калорийности рациона (контроль). В результате проведенных исследований обнаружено, что величины частот аллеля, А полиморфизма rs9939609 гена FTO и аллеля Т полиморфизма rs659366 гена UCP2 ниже, чем в европейских популяциях, и согласуются с показателями, полученными ранее для населения Арктической зоны Российской Федерации (табл. 1)
Таблица 1. Распределение генотипов и частота аллелей полиморфизмов у жителей Арктической зоны РФ в зависимости от уровня жиров в рационе [9]. Величины частот аллеля С полиморфизма rs4994 гена ADRB3 и аллеля Т полиморфизма rs5219 гена KCNJ11 в изучаемой группе выше, чем у европейцев и американцев европейского происхождения [16, 17]. В наших исследованиях мы не выявили статистически достоверной связи изучаемых генетических полиморфизмов с содержанием жира в рационе обследованных (см. табл.1).
Изучение связи содержания НЖК в рационе с изучаемыми генетическими полиморфизмами проводили по типу «случай-контроль». Для этого все обследованные были распределены в две группы: в 1-й группе содержание НЖК составляло более 10% от суточной калорийности рациона (случай), во 2-й — менее 10% от суточной калорийности рациона (контроль). Результаты исследований показали, что частота аллеля, А полиморфизма rs9939609 гена FTO в группе обследуемых с содержанием НЖК в рационе более 10% от суточной калорийности рациона на 20,2% выше по сравнению с группой с содержанием НЖК менее 10% от суточной калорийности рациона (табл. 2).
Таблица 2. Распределение генотипов и частота аллелей полиморфизмов у жителей Арктической зоны РФ в зависимости от уровня НЖК в рационе Это свидетельствует о статистически значимой ассоциации аллеля, А этого полиморфизма с высоким содержанием НЖК в рационе: ОР=1,74; 95% ДИ 1,04-2,91 при р=0,03. Таким образом, носители аллеля, А предпочитают пищу с высоким содержанием НЖК, что согласуется с данными, полученными в европейских популяциях [12]. Однако, как показано ранее при обследовании населения Арктической зоны России, у полиморфизма rs9939609 гена FTO отсутствует связь с избыточной массой тела и ожирением, в отличие от населения центральных регионов России и европейских популяций [9].
При изучении полиморфизма rs659366 гена UCP2 выявлена положительная ассоциация аллеля С с высоким содержанием НЖК в рационе у его носителей, однако эта связь не достигла статистической значимости (ОР=1,36, 95% ДИ 0,86-2,0 при р=0,19) (см. табл. 2).
Результаты изучения полиморфизмов rs4994 гена ADRB3 и rs5219 гена KCNJ11 не выявили связей с высоким содержанием НЖК в рационе у изучаемой группы (см. табл. 2).
Для более детального исследования связи полиморфизма rs9939609 гена FTO с высоким содержанием НЖК в рационе мы провели исследование по типу «случай-контроль» отдельно у мужчин и женщин. В результате проведенных исследований статистически достоверная ассоциация аллеля, А этого полиморфизма с высоким содержанием НЖК в рационе была выявлена только у женщин (ОР=1,82; 95% ДИ 1,04-3,19; р=0,04) (табл. 3).
Таблица 3. Распределение генотипов и частота аллелей полиморфизма rs9939609 гена FTO у жителей Арктической зоны России в зависимости от уровня НЖК в рационе
При изучении содержания НЖК у обследуемых в зависимости от генотипа полиморфизма rs9939609 гена FTO подтверждена статистически значимая связь аллеля, А с высоким содержанием НЖК в рационе носителей этого аллеля (табл. 4).
Таблица 4. Уровень НЖК в рационеу жителей Арктической зоны в зависимости от полиморфизма rs9939609 гена FTO (% от суточной калорийности рациона) Носители аллеля, А (генотипы АТ+АА) предпочитали пищу с более высоким содержанием НЖК в рационе в отличие от носителей генотипа ТТ (см. табл. 4). Однако при обследовании отдельно мужчин нами не выявлено статистически значимой разницы в содержании НЖК в рационе в зависимости от носительства аллеля, А изучаемого полиморфизма, в отличие от женщин, где эта разница была статистически значимой (см. табл. 4). Только при выделении в группе мужчин коренных жителей и пришлых выявлено статистически значимое увеличение содержания НЖК в рационе у носителей аллеля, А в подгруппе пришлого мужского населения (см. табл. 4).
При изучении связи полиморфизмов rs9939609 гена FTO, rs4994 гена ADRB3, rs659366 гена UCP2 и rs5219 гена KCNJ11 с содержанием жира, углеводов и добавленного сахара в рационе у обследуемых арктической зоны Российской Федерации по типу «случай-контроль» нами не было выявлено статистически значимых ассоциаций с этими показателями (табл. 5, 6).
Таблица 5. Распределение генотипов и частота аллелей полиморфизмов у жителей Арктической зоны России в зависимости от уровня углеводов в рационе Таблица 6. Распределение генотипов и частота аллелей полиморфизмов у жителей Арктической зоны РФ в зависимости от уровня добавленного сахара в рационе Можно только отметить положительную ассоциацию аллеля Т полиморфизма rs5219 гена KCNJ11 с более высоким содержанием добавленного сахара в рационе, однако эта связь не достигла статистической достоверности (ОР=1,31; 95% ДИ 0,86-2,08 при р=0,26) (см. табл. 6).
Результаты исследований подтвердили наличие генетических особенностей у жителей Арктической зоны России (Ямало-Ненецкий автономный округ). В ходе проведенных исследований обнаружено, что величины частот аллелей риска алиментарно-зависимых заболеваний полиморфизмов rs9939609 гена FTO и rs659366 гена UCP2 в среднем на 15% ниже, а полиморфизмов rs4994 гена ADRB3 и rs5219 гена KCNJ11 выше в среднем на 45 и 10% соответственно, чем у населения центральных регионов России, американцев европейского происхождения и европейцев.
Результаты проведенных исследований выявили статистически достоверную связь аллеля, А полиморфизма rs9939609 гена FTO с высоким содержанием НЖК в рационе (ОР=1,74; 95% ДИ 1,04−2,91 при р=0,03). Определены гендерные различия: статистически достоверная ассоциация аллеля, А полиморфизма rs9939609 гена FTO с высоким содержанием НЖК в рационе выявлена только у женщин (ОР=1,82; 95% ДИ 1,04−3,19 при р=0,04).
При изучении связи полиморфизмов rs9939609 гена FTO, rs4994 гена ADRB3, rs659366 гена UCP2 и rs5219 гена KCNJ11 с содержанием жира, углеводов и добавленного сахара в рационе у обследуемых Арктической зоны Российской Федерации не было выявлено статистически значимых ассоциаций с этими показателями.
Научно-исследовательская работа по подготовке рукописи проведена за счет средств субсидии на выполнение государственного задания в рамках Программы Фундаментальных научных исследований государственных академий наук на 2013-2020 гг. (тема № 0529−2016−0024).
Участие авторов:
Концепция и дизайн — Е.С., Э.К., А.Б.
Сбор и обработка материала — Э.К., И.К., Е.С.
Статистическая обработка данных, написание текста — Е.С., Э.К.
Редактирование — А.Б.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
*Батурин Александр Константинович — д.м.н., проф. [Aleksandr K. Baturin, MD, Professor]; адрес: 109240, Россия, Москва, Устьинский проезд, д. 2/14 [address: 2/14 Ust’inskiy proezd, Moscow, 109240, Russia]; https://orcid.org/0000-0002-7455-2372, eLibrary SPIN: 8779-5240; : baturin@ion.ru
Сорокина Елена Юрьевна — к.м.н., в.н.с. [Elena Y.Sorokina, PhD, Leader reer]; https://orcid.org/0000-0002-6530-6233, eLibrary SPIN: 6369-2605; : sorokina@ion.ru
Кешабянц Эвелина Эдуардовна — к.м.н., с.н.с. [Evelina E. Keshabyants, PhD, Senior reer]; https://orcid.org/0000-0001-9762-2647, eLibrary SPIN: 1141-9666; : evk1410@mail.ru
Кобелькова Ирина Витальевна — к.м.н., с.н.с. [Irina V. Kobelkova, PhD, Senior reer]; https://orcid.org/0000-0002-1237-5147, eLibrary SPIN: 1190-1096; : iriit66@mail.ru
Источник